Robots en la medicina actual
José Carlos Arroyo Kuribreña
Ver en el PDF
Recientemente se instaló en Puebla un robot Da Vinci para la realización de procedimientos laparoscópicos asistidos por robot. Para utilizar esta tecnología se requiere de un entrenamiento específico, después del cual es posible realizar cirugías que antes eran consideradas de elevada complejidad y que con este robot se facilitan al punto de que puede extenderse la práctica quirúrgica a procedimientos más complejos, con más seguridad y precisión, y con una recuperación del paciente más rápida, con menos dolor y mejores resultados. Es curioso pensar que aún se está muy lejos de poder utilizar robots en la vida diaria como se ilustra en muchas películas futuristas, y sin embargo, cada vez estamos más rodeados de robots que participan rutinariamente en la vida diaria; por ejemplo, nadie se sorprende por una aspiradora robótica que tiene la capacidad de planear, aspirar y trapear una casa, y al terminar guardarse y recargarse; tampoco impresiona la gran difusión que tiene un sistema robótico de cocina que prepara todo tipo de platillos gourmet, envía al teléfono inteligente la lista del supermercado para la receta, y al terminar se lava sola; o los robots en las calles, como sucede en Estados Unidos, que ayudan a la vigilancia de edificios comerciales; tampoco extraña que cada vez haya más robots en la práctica médica actual.
Una duda importante es si los pacientes le confían más su salud, intimidad y enfermedades a una máquina, y así se evitan el contacto con otro ser humano. Incluso se ha llegado a proponer que muchas personas tienen más confianza en una máquina que en un profesional de la salud para ayudarles a recuperarse de una enfermedad. Se trata, sin duda, de un fenómeno interesante; sin embargo, se puede caer en el extremo de deshumanizar más la medicina actual.
A continuación se revisan cuatro grandes grupos de robots que participan en la medicina: 1) robots empleados para transportar medicamentos o para la limpieza de habitaciones; 2) robots utilizados en cirugía, que incluyen brazos robóticos aislados o en conjunto; 3) robots especializados en la rehabilitación de pacientes con discapacidades físicas o extremidades protésicas (Gyles, 2019), y 4) robots androides que asisten a los enfermos en su vida diaria.
Actualmente, los robots se han ido programando para realizar ciertas tareas que facilitan el tratamiento de los pacientes y evitan que el personal médico se ocupe en actividades que consumen tiempo y pudieran ser rutinarias y sencillas. Un ejemplo de esto son los robots encargados de entregar resultados de laboratorio o medicamentos, que como en las fábricas de automóviles en que los robots distribuyen el material en el momento exacto, transportándolos desde la bodega hasta la máquina encargada del ensamblaje, repiten los mismos procesos con la distribución de fármacos, muestras médicas y material hasta las habitaciones de los pacientes o centrales de enfermería, y lo hacen con mayor control gracias a códigos de seguridad tanto en los pacientes como en las farmacias y el almacén del hospital. El uso de este tipo de robot es adecuado en situaciones tales como la pandemia de COVID-19, en la que la diseminación de la enfermedad se ha debido principalmente al contacto directo entre personas, y que llevó al distanciamiento social como medida preventiva. Otra posibilidad es dejar que los robots realicen actividades de aseo y descontaminación, ya sea con luz ultravioleta o materiales sanitizantes que podrían ser dañinos o tóxicos para el ser humano al momento de aplicarlos en las habitaciones de los enfermos; el empleo de robots en estas actividades evitaría poner en peligro al personal de limpieza. Otra tarea idónea para un robot es la distribución de medicamentos sin contacto entre el personal de salud y el enfermo; su utilidad ha hecho que en muchos centros hospitalarios del mundo proliferen estos robots mensajeros y de limpieza (pudurobotics.com).
Dentro de esta nueva normalidad de actividades a distancia, también proliferaron robots que permitieron conferencias y consultas en línea con los pacientes infectados por COVID-19, lo que permitió que se mantuvieran en contacto con su familia y con equipos de soporte psicológico que estuvieron dando terapia para apoyo emocional a pacientes aislados por padecer esta enfermedad contagiosa. Ejemplos de estos equipos son los que se implementaron en la ciudad de México en el Centro Médico Nacional 20 de Noviembre, en el que robots mexicanos llamados Robotina Covidia y Davinchito Robotino, que son robots con movimiento y con pantallas para interactuar con los pacientes, permitieron trabajar al Departamento de Psicología y Psiquiatría con los enfermos hospitalizados sin poner en riesgo al personal médico (saluddigital.com).
Algunos de los sistemas que más difusión han tenido en la actualidad son los llamados sistemas robóticos pasivos. Estos sistemas involucran un brazo robótico que puede sostener un instrumento, como una cámara endoscópica, sin temblor y en una posición exacta que permite realizar una cirugía laparoscópica; ejemplo de esto es el robot Aesop®, que se posiciona mediante el movimiento directo del brazo, o bien es guiado por la voz del cirujano. Recientemente se han implementado microscopios en el brazo robótico, lo que permite realizar neurocirugías con mayor exactitud con el sistema Aesculap Aeos® (bbraun.com). Otro ejemplo es el sistema Rosa, de Zimmer Biomet®, utilizado en cirugía de rodilla, que durante el procedimiento fija y alinea la rodilla del paciente, al tiempo que transmite retroalimentación del tejido que se está cortando para que la colocación de la prótesis de rodilla sea exacta e individualizada para cada persona (zimmerbiomet.com). También existen brazos robóticos que al planear el área a retirar de la próstata con un ultrasonido simultáneo, sostienen ambos equipos y cortan progresivamente la próstata, ya sea con electricidad o con un chorro de agua muy intenso.
Esta modalidad de robots se ha repetido con otros sistemas que permiten fijar extremidades en cierta posición sin cambio. Esto puede ser de gran utilidad en una cirugía de ortopedia en la que el hueso se va a reparar usando tornillos y placas, y para ello se requiere fijar la fractura mientras el cirujano aplica estos materiales. Otro sistema robótico que se basa en la misma tecnología es el utilizado en neurocirugía, en la que se planea un procedimiento basado en imágenes obtenidas previamente del cerebro del paciente y entonces el robot repite con exactitud la ruta que se propuso durante la planeación.
Esto previene dañar áreas críticas del cerebro o la médula espinal, permite un mayor éxito en estos procedimientos, y disminuye el temblor o fatiga humana del cirujano que podría provocar lesiones irreparables a los pacientes. En esta modalidad se incluye un sistema para cirugía endoscópica en urología en el que el robot sostiene una cámara muy fina llamada ureteroscopio flexible, que tiene la capacidad de ascender a través del sistema urinario, hasta los riñones, para ahí romper y extraer las piedras urinarias, con la ventaja de mantener la posición que el cirujano establece, disminuyendo así la fatiga, eliminando el temblor y el cambio de ubicación involuntaria durante el procedimiento.
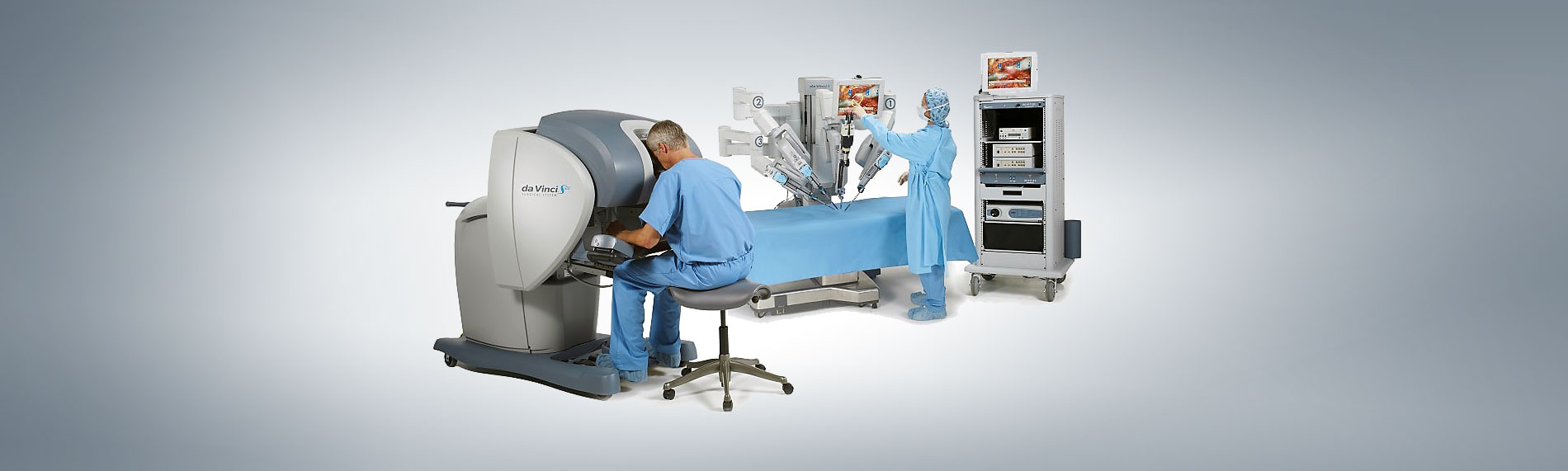
El sistema más reconocido de cirugía robótica es un sistema maestro-esclavo que se ha difundido gracias a la empresa Intuitive® que durante 20 años ha conservado la patente del robot Da Vinci®, y con el cual se han realizado hasta la fecha más de 5 millones de cirugías asistidas por robot en todo el mundo. Es un sistema que se compone de hasta cuatro brazos de los que uno sostiene la cámara de tercera dimensión para realizar el procedimiento laparoscópico con un gran aumento, en tanto que los otros tres se montan en puertos de trabajo, conocidos como trocares, para introducir instrumentos como pinzas y tijeras durante el procedimiento. Todos los brazos repiten los movimientos del cirujano, el cual se encuentra en una consola lejos del paciente. El sistema disminuye el temblor del cirujano, con mayor aumento en la imagen a través de una visión tridimensional, y posee sistemas que reproducen la acción de las articulaciones de la muñeca sobre los instrumentos (intuitive.com).
Recientemente se han desarrollado nuevas plataformas de cirugía que tienen interesantes modificaciones, como brazos no anclados al aparato principal. Los nuevos sistemas incorporan incluso técnicas denominadas de puerto único, que es un solo trocar en el que se introducen los instrumentos y la cámara articulados, de forma que simulan los movimientos de una serpiente que permite que los movimientos y articulaciones se alejen del centro de trabajo para no obstruir la visibilidad; estos robots permiten realizar la cirugía con una sola incisión (titanmedicalinc.com).
Otro tipo de robot es el que se usa como aditamento agregado sobre el individuo. Este ramo importante de soporte robótico se originó en la industria de la construcción, en la que un sistema o exoesqueleto de soporte permite a los pintores ascender sin andamios y dar apoyo a los brazos para evitar la fatiga empleando motores externos que amplían los movimientos del trabajador. Tales avances tecnológicos se han aplicado con gran éxito en la fisioterapia y la rehabilitación, en las que se emplean sistemas de exoesqueletos, o robots, que se sobreponen al cuerpo humano para mover a los pacientes a la manera de una grúa unida a los brazos del personal, pero con una mayor fuerza y sin esfuerzo ni fatiga para mover al paciente que se encuentra limitado en sus movimientos.
También se han utilizado estos equipos en pacientes que tienen parálisis o muy poca fuerza; en ellos, mediante un estímulo eléctrico mediado por los nervios del paciente, o con los movimientos sutiles que le restan al mismo, se mueve el robot, permitiendo al sujeto realizar actividades que de otro modo serían imposibles por su limitada fuerza, como caminar o moverse (m.cyberdyne.jp). Estos robots se han reducido a tamaños muy pequeños, hasta el punto de que se ha logrado hacer extremidades robóticas, como manos, que mediante conexiones con los nervios que conserva el paciente amputado, le permiten mover dedos y manos robóticos para sustituir la extremidad perdida.
Finalmente, están los robots tipo androide, que pueden servir como mascota de compañía por ser similares a un perro, o tener forma humanoide, y a los que una persona restringida a una silla de ruedas puede solicitarles que realicen tareas simples, como bajar o subir objetos dentro de la casa, tomar fotografías o videos, y obedecer indicaciones verbales (www.toyota.es).
Todos estos sistemas robóticos tienen como objetivo la exactitud y la eficiencia en las actividades que realizan o ayudan a realizar, y están sustentados en reportes y análisis actualizados acerca de cómo se han conseguido los resultados obtenidos para mejorarlos continuamente, con el beneficio de disminuir la fatiga del personal de salud y las complicaciones asociadas a la atención de la enfermedad, incluyendo el riesgo de contagio de enfermedades infectocontagiosas, gracias al distanciamiento del médico con el paciente; sin embargo, es importante considerar que también disminuye la parte de contacto humano que es medular en la medicina.
Podemos suponer que la perspectiva de la robótica médica será, primero, un menor costo de los sistemas, que se dará gracias a la competencia de nuevas empresas y a la reducción de los costos de producción de los componentes, lo cual facilitará una mayor difusión y uso por la población general. Otro aspecto importante que habrá que atender en el futuro será incrementar la portabilidad de los robots para poder incluirlos en las actividades rutinarias, hasta el punto en que se desarrollen micro o nanorrobots que se podrán inyectar en el cuerpo humano para que, como en la película Viaje fantástico (Richard Fleischer, 1966), migren para llegar al órgano enfermo y ahí tomen biopsias para el análisis de la enfermedad, o administren medicamentos a dosis muy bajas por estar directamente sobre el tejido anormal, e incluso corten y reparen los órganos mediante el uso de láser y pegamentos en el sitio a tratar, sin tener que abrir al paciente, que es lo que ocasiona daño al individuo y retraso en su recuperación.
Un aspecto pendiente de resolver en los sistemas robóticos es la pérdida de la percepción del tacto, puesto que el robot no siente la resistencia de los tejidos o materiales con los que trabaja, y el cirujano solamente siente la resistencia de los resortes y articulaciones de la plataforma robótica, lo que hace que la cantidad de fuerza que se aplica a través del brazo robótico, se traduzca por lo que se está viendo con los ojos y no por lo que se siente con el tacto. La perspectiva será que los sistemas robóticos tendrán que retransmitir a los instrumentos las características táctiles del material con el que se trabaja para que realmente se incluya el sentido del tacto durante el uso del robot y se consiga una actividad más envolvente para el operador. Esto tiene una gran importancia durante un procedimiento quirúrgico, porque durante la cirugía tradicional el cirujano se guía con lo que palpa con las manos, y esto se pierde con los sistemas robot-esclavo actuales porque no hay ninguna resistencia en la consola que simule la resistencia de los tejidos con los que se está trabajando, pero una posible solución es que el robot detecte las características de los tejidos que está tocando y las transmita como información al cirujano. Esto también tendrá que implementarse en los sistemas de exoesqueletos, porque al mover los objetos será ideal que la persona sienta la resistencia y consistencia de lo que está moviendo.
En el futuro, los robots en la cirugía van a ser muy pequeños y portátiles, como cangrejos que tendrán instrumentos con puntas intercambiables que van a permitir, mediante bluetooth o tecnología inalámbrica, que el cirujano dirija la cirugía en un ambiente más envolvente con apoyo de cámaras e imágenes radiográficas previas que permitirán planear la cirugía antes de su realización, y que al momento del procedimiento identifiquen y avisen cuáles son las estructuras a cuidar, como los vasos sanguíneos o los nervios, y delimiten el tejido enfermo para que, incuso con fotografía microscópica, puedan ayudar a definir el punto de corte en el que, por ejemplo, las células cancerosas dan un margen a las células sanas, permitiendo quitar los tumores completos, curando así la enfermedad que se está tratando.
En resumen, los robots en medicina están muy presentes en la actualidad, y van a participar cada vez más en el cuidado y atención de los enfermos para mejorar la calidad de vida del ser humano. Sin embargo, todavía estamos lejos de que sea el robot el que tome en forma autónoma la decisión del tratamiento sin el consentimiento, indicación o aprobación de un médico o un ser humano, para asegurar que se tome la mejor opción de manejo para los pacientes. Pero ya se realizan estudios y análisis computacionales que no están lejos de establecer diagnósticos y tratamientos independientes de la opinión de un médico.
REFERENCIAS
Gyles C (2019). Robots in medicine. Can Vet J. 60(8):819820. https://www.pudurobotics.com/.
https://bbraun.com/en/products-an-therapies/neurosurery/aesculap-aeos.html.
https://titanmedicalinc.com/technology/.
https://www.toyota.es/world-of-toyota/articles-news-events/robots-Toyota-movilidad.