Vesículas extracelulares: ¿caballos de Troya para los virus?
Itzel Alejandra Rivera Ruz, Moisés León Juárez
Ver en el PDF
En el microambiente celular existe una comunicación entre células por medio de la cual se transportan proteínas, lípidos y ácidos nucleicos para activar o inactivar diversas vías de señalización. Las células tienen la capacidad de empaquetar estas moléculas en vesículas que después serán secretadas al exterior de las células.
Este método de comunicación es empleado por las células para evitar que las moléculas sean degradadas y no activar la respuesta del sistema inmunitario hacia ellas, teniendo como resultado una comunicación eficiente entre células sin importar si es a corta o a larga distancia (Maravillas-Montero y Martínez-Cortés, 2017; Tabata et al., 2016).
Las vesículas extracelulares (EVs) se componen de una estructura membranosa rodeada por una bicapa lipídica y una composición de proteínas transmembrana que puede variar según el tipo celular de origen, el estado fisiológico de la célula y las condiciones ambientales. Estos componentes hacen que las EVs sean estructuras versátiles y mediadoras de la comunicación intercelular (Tabata et al., 2016; Yates et al., 2022).
Existen clasificaciones de estas vesículas según su tamaño (grandes > 200 nm y pequeñas < 200 nm), origen y biogénesis. Un grupo principal de EVs lo constituyen las vesículas apoptóticas (100-5,000 nm), que se generan de la gemación (proceso en el que la célula forma vesículas pequeñas o cuerpos apoptóticos derivados de su membrana, que contienen fragmentos de material celular que serán eliminados de manera ordenada) de células que están en un proceso de muerte celular.
Otro de ellos está constituido por los ectosomas (30-150 nm), que son pequeñas vesículas heterogéneas generadas por gemación de la membrana plasmática en una variedad de tipos celulares. Por último, podemos mencionar a los exosomas (30-120 nm), que se generan a partir de la segmentación interna de los compartimentos endosómicos, y tienen la capacidad de fusionarse con la membrana plasmática para poder salir y liberarse al medio extracelular (Arroyo y Zazueta, 2021; Jeppesen et al., 2023).
EXOSOMAS
Este tipo de EVs es uno de los más estudiados en los últimos años, entre otras razones porque, según el tipo de molécula que se haya introducido en ellas, se puede producir un cambio en la célula diana y, por lo tanto, en el microambiente.
La formación de los exosomas es un proceso celular complejo que comienza con la biogénesis de endosomas multivesiculares (MVB), que se originan a partir de las membranas endosómicas que contienen moléculas internalizadas durante la endocitosis. A medida que estos endosomas evolucionan hacia MVB, se forman en su interior vesículas más pequeñas que contienen diversos cargamentos biológicos (proteínas, lípidos y ácidos nucleicos; Figura 1). Posteriormente, los MVB pueden seguir dos destinos: fusionarse con otros compartimentos celulares para la degradación de su contenido, o fusionarse con la membrana plasmática para salir al medio extracelular (Arroyo y Zazueta, 2021; Fordjour et al., 2022; Jeppesen et al., 2023).
VIRUS Y SUS ESTRATEGIAS DE INFECCIÓN
Los virus son entidades microscópicas que se componen de proteínas y material genético (ADN o ARN); se caracterizan por actuar como un tipo de parásito obligado ya que, al carecer de una maquinaria metabólica y replicativa propia, necesitan infectar células hospederas para poder reproducirse y completar su ciclo de vida (Yates et al., 2022).
A lo largo del tiempo, los virus han desarrollado una gran variedad de estrategias para infiltrarse y aprovechar las maquinarias celulares, lo que resulta en su propagación. La facultad de un virus para infectar exitosamente a su hospedero depende en gran medida de sus estrategias de entrada y replicación, así como de su capacidad de evadir al sistema inmunitario.
Algunas de las estrategias que suelen utilizar son: 1) la entrada a la célula hospedera por medio de receptores específicos; 2) su variación genética, para dificultar la detección por el sistema inmunitario; 3) la supresión de la respuesta inmunitaria mediante su interferencia con componentes clave del sistema de defensa celular; 4) por medio de un estado de latencia, ya que algunos virus pueden permanecer inactivos en la célula hospedera durante periodos prolongados, en espera del mejor momento para reactivarse; 5) utilizando la llamada transferencia horizontal, por medio de la cual los virus pueden aprovecharse de vectores como insectos u otros animales para transmitirse entre hospederos (Fordjour et al., 2022).
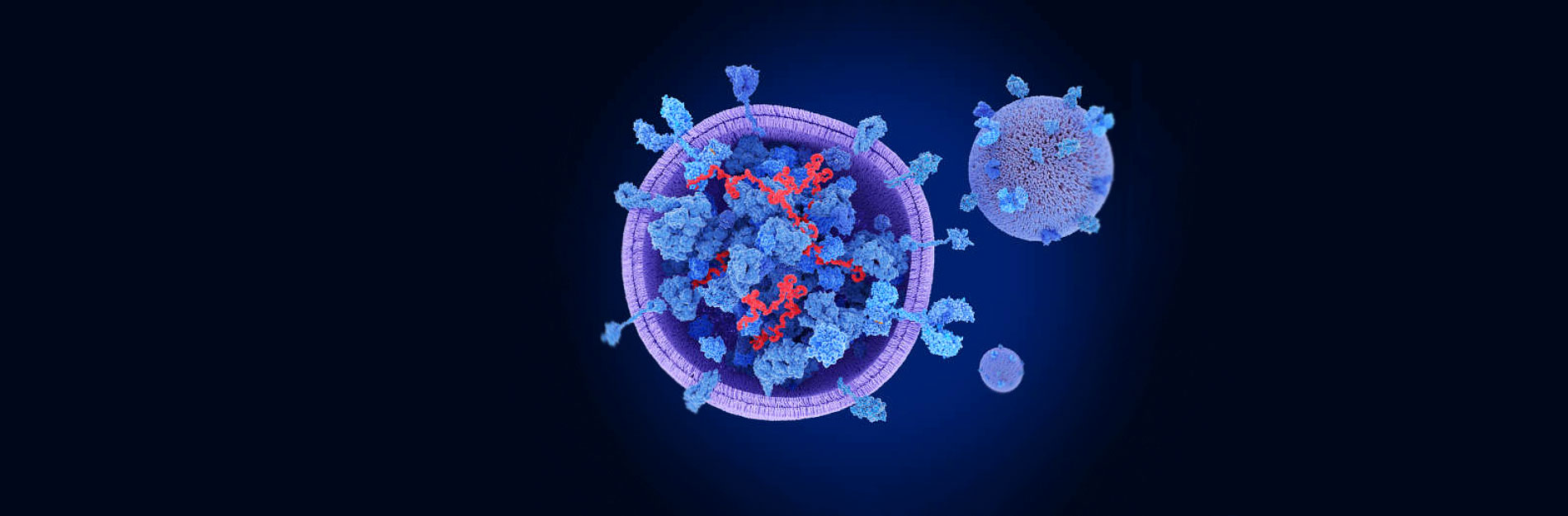
Sin embargo, recientes investigaciones han descubierto que algunos virus parecen tener un mecanismo de infección diferente a los ya conocidos, y es por medio de las vesículas extracelulares, las cuales parecen ser el caballo de Troya perfecto para infectar células tanto de tejidos cercanos como lejanos y, al mismo tiempo, evadir el sistema inmunitario.
Esto añade un nivel adicional de complejidad a la comprensión sobre los virus y ha abierto nuevas vías para profundizar en la investigación antiviral y el desarrollo de terapias específicas (Kerviel et al., 2021; Maravillas-Montero y Martínez-Cortés, 2017; Yates et al., 2022).
¿SON LOS EXOSOMAS CABALLOS DE TROYA?
En la búsqueda por comprender las interacciones que existen entre los virus y sus hospederos, se ha realizado un fascinante hallazgo: el empleo de exosomas como medio de transporte estratégico para promover la infección viral. Este fenómeno sigue siendo objeto de intensa investigación, ya que ha proporcionado una visión más amplia sobre cómo los virus aprovechan las vesículas extracelulares para optimizar su propagación y supervivencia (Lee y Shin, 2023; Safadi et al., 2023; Tabata et al., 2016).
Investigaciones recientes han mostrado que las células C6/36 de mosquitos Aedes Albopictus que son infectadas con el virus de Zika, tienen la capacidad de liberar exosomas. Se ha demostrado, además, que estas vesículas contienen ARN y proteínas virales. Este hallazgo no solo sugiere un papel activo de los exosomas con carga de moléculas virales, sino que también apunta a una función en la propagación del virus dentro del mosquito (Lee y Shin, 2023; Safadi et al., 2023; Yates et al., 2022).
Otro descubrimiento asombroso es que algunos flavivirus, como el del dengue y el zika, tienen la capacidad de asociar diversas proteínas, como la proteína no estructural NS1, con los exosomas de líneas celulares permisivas a la infección, lo que plantea preguntas cruciales sobre el papel de los exosomas en la gravedad de la patogénesis y en la respuesta inmunitaria durante las infecciones por estos virus (Lee y Shin, 2023; Safadi et al., 2023; Yates et al., 2022).
Incluso se ha sugerido que, en virus respiratorios como el de la influenza y los coronavirus, los exosomas pueden jugar un papel clave como medio de transmisión intercelular y en la evasión del sistema inmunitario. Además, se ha demostrado que algunos virus manipulan la biogénesis de los exosomas; esto destaca la capacidad del patógeno para modificar la composición, el tamaño y la cantidad de las vesículas con tal de facilitar el transporte de componentes virales (Lee y Shin, 2023; Safadi et al., 2023; Yates et al., 2022).
Estos antecedentes subrayan la versatilidad de los virus para adaptarse y aprovechar las vesículas extracelulares, particularmente los exosomas, como parte integral de sus estrategias de infección. Una posible estrategia que falta por evaluar, es la posibilidad de que los exosomas con elementos virales puedan ser un sistema para evadir la respuesta inmunitaria del hospedero, al poder camuflajearse con estas vesículas celulares. Este intrigante campo de investigación promete proporcionar conocimientos esenciales para el desarrollo de enfoques antivirales más precisos y eficaces, que nos ayuden a cerrar el paso a los caballos de Troya virales (Figura 2) (Lee y Shin, 2023; Safadi et al., 2023, Yates et al., 2022).
REFERENCIAS
Arroyo M (2021). Trascendencia de los exosomas en la cardiología: heraldos de la cardioprotección. Archivos de Cardiología de México 91(1):105-113.
Fordjour F (2022). A shared, stochastic pathway mediates exosome protein budding along plasma and endosome membranes. Journal of Biological Chemistry 298(10):102394.
Jeppesen D (2023). Extracellular vesicles and nanoparticles: emerging complexities. Trends Cell Biol. 33(8):667-681.
Kerviel L (2021). A New Infectious Unit: Extracellular Vesicles Carrying Virus Populations. Annual Review of Cell and Developmental Biology 37:171-197.
Lee J (2023). Zika virus modulates mitochondrial dynamics, mitophagy, and mitochondria-derived vesicles to facilitate viral replication in trophoblast cells. Frontiers in Immunology 14:1203645.
Maravillas M (2017). Los exosomas de las células presentadoras de antígeno y su papel en la regulación de las respuestas inmunológicas. Revista Alergia México 64(4):463-476.
Safadi D (2023). Extracellular Vesicles Are Conveyors of the NS1 Toxin during Dengue Virus and Zika Virus Infection. Viruses 15(2):364.
Tabata T (2016). Zika Virus Targets Different Primary Human Placental Cells, Suggesting Two Routes for Vertical Transmission. Cell Host & Microbe 20(2):155-66.
Yates A (2022). In sickness and in health: The functional role of extracellular vesicles in physiology and pathology in vivo. Journal of Extracellular Vesicles 11(1):e12190.